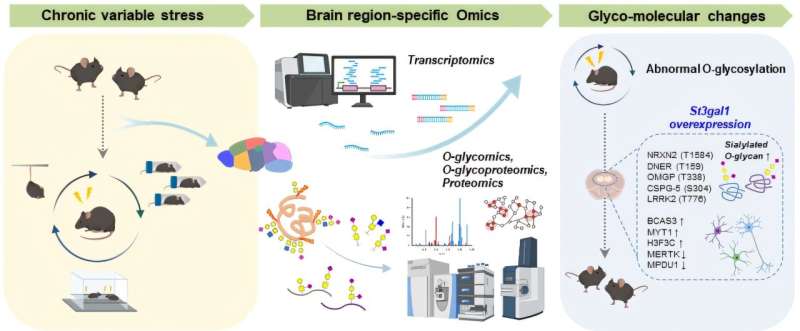
Депрессия — это серьезное расстройство, которое нарушает повседневную жизнь из-за вялости, нарушения сна и замкнутости в обществе, а также увеличивает риск самоубийства. Число пациентов с депрессией неуклонно росло на протяжении многих лет, и к 2025 году оно превысит 280 миллионов человек по всему миру. Теперь исследователи обнаружили новый патологический механизм, который может дать ключ к диагностике и лечению депрессии.
Исследовательская группа под руководством К. Джастина Ли и Ли Бойонга из Института фундаментальных наук (IBS) выявила новый молекулярный путь в мозге, который напрямую связывает аномальные изменения сахара в белках с депрессивным поведением. В частности, хронический стресс разрушает сахарные цепочки (О-гликаны), связанные с белками в префронтальной коре, тем самым вызывая депрессию.
Результаты, опубликованные в журнале Science Advances, открывают новые возможности для целенаправленной терапии депрессии, устойчивой к лечению.
Депрессия возникает в результате сложного взаимодействия психологических, экологических и генетических факторов, а также множества различных патологических механизмов. Однако большинство антидепрессантов, используемых в клинической практике, направлены на регулирование нейромедиаторов, особенно серотонина.
Однако эти препараты помогают лишь примерно половине пациентов и часто вызывают побочные эффекты, такие как желудочно-кишечные проблемы или усиливающееся беспокойство. Это ограничение подчеркивает необходимость поиска новых молекулярных путей в мозге, помимо передачи сигналов нейромедиаторами.
Исследователи сосредоточились на гликозилировании — процессе, посредством которого небольшие цепочки сахаров присоединяются к белкам и изменяют их структуру и функции. Гликозилирование было признано важным механизмом при различных заболеваниях, включая рак, вирусные инфекции и нейродегенеративные расстройства. Среди его форм О-гликозилирование играет важную роль в передаче сигналов клетками и поддержании баланса в нервных цепях, хотя его участие в заболеваниях головного мозга только недавно начали изучать.
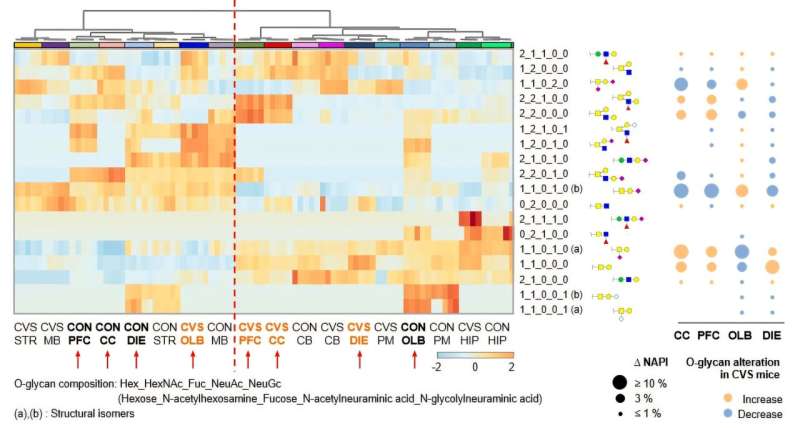
Используя высокоэффективную масс-спектрометрию, команда сначала проанализировала закономерности О-гликозилирования в девяти областях мозга здоровых мышей и обнаружила, что каждая область демонстрирует различные особенности гликозилирования. Затем они сравнили их с данными мозга мышей, испытывающих хронический стресс, и выявили значительные изменения в О-гликозилировании в таких областях, как префронтальная кора.
В частности, они наблюдали снижение сиалилирования — добавления сиаловой кислоты к концам сахарных цепочек, которая стабилизирует белки, — наряду со снижением экспрессии фермента St3gal1, который опосредует эту модификацию.
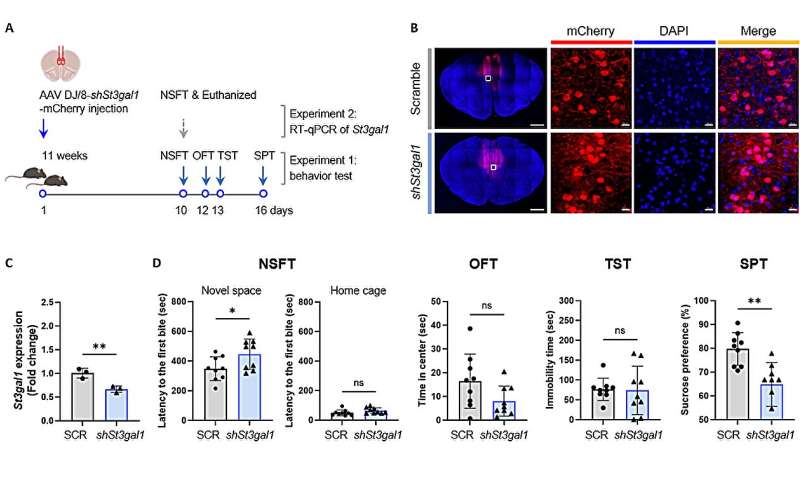
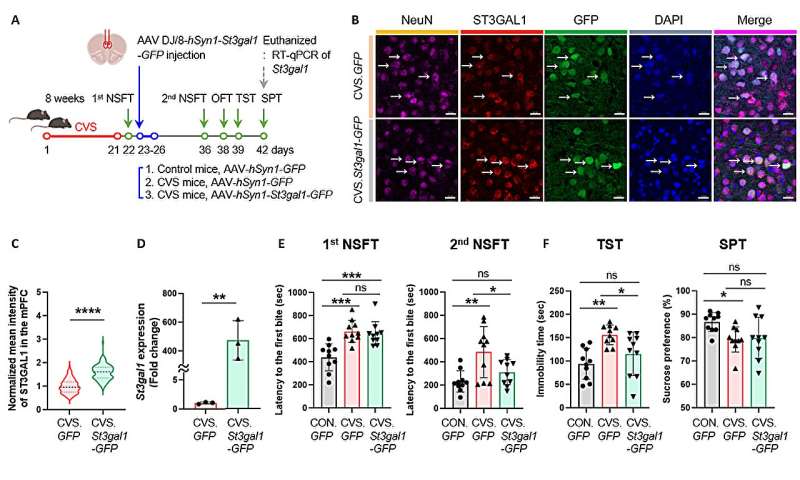
Чтобы проверить, связан ли этот фермент напрямую с депрессивным поведением, исследователи манипулировали экспрессией St3gal1 в префронтальной коре головного мозга как у нормальных, так и у испытывающих стресс мышей. Подавление St3gal1 у нормальных мышей вызывало у них симптомы, похожие на депрессию — потерю мотивации, повышенную тревожность — даже без стресса. И наоборот, повышение уровня St3gal1 у мышей, подвергшихся стрессу, облегчало их депрессивное поведение. Эти результаты указывают на снижение уровня St3gal1 как на ключевой молекулярный фактор, который непосредственно вызывает и регулирует симптомы депрессии.
Дальнейшие анализы белков и электрофизиологические эксперименты показали, что снижение уровня St3gal1 дестабилизирует структуру сахарных цепочек синаптических молекул, включая нейрексин 2 (NRXN2), белок синаптической адгезии, и нарушает функцию тормозных нейронов, которые обычно помогают поддерживать баланс в мозговых цепях. Другими словами, небольшие изменения в сахарных цепочках одновременно нарушают как связи, так и стабильность нейронных цепей, что в конечном итоге приводит к разрушению системы регуляции эмоций в мозге.
«Это исследование демонстрирует, что аномальное гликозилирование в мозге напрямую связано с возникновением депрессии», — сказал научный сотрудник Боюнг Ли. «Это обеспечивает важную основу для выявления новых диагностических маркеров и терапевтических мишеней, помимо нейротрансмиттеров».
«Депрессия является серьезным социальным бременем, однако существующие методы лечения остаются ограниченными», — добавил директор C. Джастин Ли. «Это достижение может распространиться не только на терапию депрессии, но и на другие психические заболевания, такие как ПТСР и шизофрения, прокладывая путь к более широким терапевтическим стратегиям».
Дополнительная информация: Youngsuk Seo и соавт., Аномальное сиалирование О-гликана в mPFC способствует депрессивному поведению у самцов мышей, Science Advances (2025). DOI: 10.1126/sciadv.ady2733.
Информация о журнале: Достижения науки