Генная терапия, проведенная в мозг, задержала прогрессирование симптомов как минимум на три года
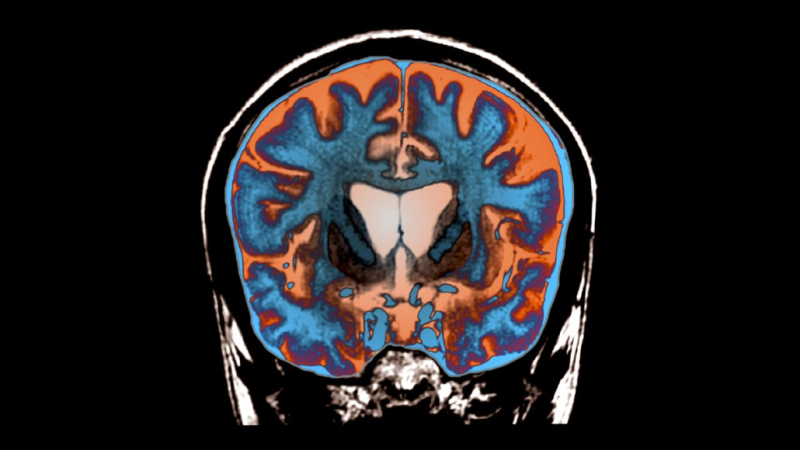
Это мозг человека с болезнью Хантингтона. Желудочки — открытые полости для циркуляции спинномозговой жидкости — расположены в центре и намного больше, чем обычно, что является признаком дегенерации близлежащих областей мозга.
Даже при упоминании словосочетания “болезнь Хантингтона” в комнате внезапно становится сумрачно. Таким образом, радость, которая сопровождала недавнее объявление о результатах экспериментальной генной терапии смертельных заболеваний, сигнализировала о незнакомом чувстве надежды.
В ходе небольшого клинического испытания инъекции вируса, кодирующего крошечный сегмент РНК, в мозг, возможно, предотвратили образование белков-изгоев, которые делают болезнь Хантингтона такой разрушительной. Первые результаты, объявленные 24 сентября в пресс-релизе, показывают, что за три года лечение замедлило прогрессирование болезни Хантингтона на 75 процентов. Хотя это лечение и не является лекарством, оно потенциально может подарить людям, живущим с болезнью Хантингтона, которые в противном случае могли бы столкнуться с ранней инвалидностью и смертью, еще много лет жизни.
“Мы занимаемся наукой, потому что это интересно и важно, но мы также участвуем в этой игре, чтобы спасти наших друзей и семью от ужасной участи”, — говорит Эд Уайлд, невролог из Университетского колледжа Лондона. “Это самая значимая вещь — посмотреть в глаза своим друзьям и [сказать]: ”Мы сделали это».
В настоящее время у болезни Хантингтона нет эффективных методов лечения. Это относительно редкое заболевание, поражающее примерно 7 из каждых 100 000 человек, и является результатом мутации в одном гене, который называется хантингтин. По словам Рассела Снелла, генетика из Университета Окленда в Новой Зеландии, который не принимал участия в исследовании, при заболевании этот ген мутирует только в одном направлении, заставляя передний конец полученного белка расти.
Этот повышенный уровень хантингтина является токсичным белком. Он накапливается в головном мозге и убивает клетки в основном в областях мозга, ответственных за произвольные движения. В конечном итоге у пациентов усиливаются непроизвольные движения, скованность, возникают трудности с речью и глотанием, а также когнитивные нарушения. Болезнь Хантингтона является генетически доминантной — для ее возникновения требуется всего одна копия дефектного гена, — поэтому у потомства пациента есть 50-процентный шанс унаследовать это заболевание.
Уайлд и его коллеги, работающие с голландской фармацевтической компанией UniQure, использовали микроРНК — крошечные сегменты РНК, которые могут запускать механизм расщепления РНК хантингтина до того, как она превратится в белок. В некоторых других исследованиях были предприняты попытки простого введения некоторых из этих РНК, но они не увенчались успехом, возможно, из-за того, что они были введены в спинномозговую жидкость и не смогли проникнуть в нужные участки мозга.
На этот раз ученые ввели их непосредственно в мозг, упаковав внутри хорошо изученного вирусного вектора. Вирус “заражает” нейроны головного мозга РНК, и “по сути, он перепрограммирует нейрон, превращая его в фабрику для молекулы, которая запрещает ему производить белок хантингтин”, — говорит Уайлд.
В ходе операции, длившейся от 12 до 18 часов, 17 пациентам с ранними симптомами болезни Хантингтона были сделаны инъекции вирусной нагрузки в три точки с каждой стороны соответствующих областей мозга. Затем исследовательская группа обследовала 12 из этих пациентов в течение 36 месяцев, проверяя их двигательные показатели, внимание, рабочую память и то, насколько хорошо они справляются со своей повседневной жизнью. “Это был настоящий героизм, как со стороны пациентов, так и со стороны врачей”, — говорит Снелл.
Лечение не остановило прогрессирование заболевания. Но по сравнению с пациентами, которые не получали лечения, у тех, кто получал самую высокую дозу препарата, снижение когнитивных и двигательных симптомов в среднем на 75% уменьшилось в течение 36 месяцев.
Один из пациентов — бывший специалист по информационным технологиям, которому пришлось прекратить работу из-за симптомов. “Примерно через год после проведения генной терапии он смог вернуться к работе”, — говорит Уайлд. По словам Уайлда, за 20 лет его исследований это был единственный пациент, который смог это сделать. Но другие, которые ожидали, что к этому времени будут передвигаться в инвалидном кресле, “все еще ходят”.
По словам Дэвида Рубинштейна, нейробиолога из Кембриджского университета, который не принимал участия в исследовании, их симптомы почти стабилизировались. Хотя речь идет о небольшом количестве пациентов, “на первый взгляд, я думаю, что это весьма многообещающе».
Уайлд и его коллеги также отслеживали степень повреждения нервных клеток в спинномозговой жидкости пациентов, уровень белка, называемого легкой цепью нейрофиламентов. По его словам, сразу после лечения показатели возросли, как и ожидалось после инвазивной операции на головном мозге, но затем снизились. В то время как оценка людьми своих симптомов может быть подвержена эффекту плацебо, говорит Уайлд, нейрофиламенты — нет. “И к третьему году это снижение по сравнению с исходным уровнем сохранилось, что замечательно”.
Продолжается работа над следующим шагом: привлечение большего числа пациентов для участия в многоцентровых исследованиях и работа над уменьшением всплеска нейрофиламентов сразу после операции.
По словам Рубинштейна, эти более масштабные испытания необходимы, и, хотя данные будут отправлены в Управление по контролю за продуктами и лекарствами США в надежде на одобрение, текущие результаты не были опубликованы или проанализированы экспертами. Если это будет одобрено, лечение будет дорогостоящим, поскольку каждая доза должна быть приготовлена в лаборатории. “Нужно придерживаться средней линии”, — говорит он, — «между энтузиазмом и осторожностью». Но “если бы это был мой эксперимент, я был бы на седьмом небе от счастья”.
Терапия не будет доступна до тех пор, пока результаты не будут проанализированы экспертами и лечение не будет одобрено государственными органами, такими как Управление по контролю за продуктами и лекарствами США, соглашается Энн Россер, невролог из Кардиффского университета в Уэльсе, которая помогала проводить исследование. Другой важной проблемой является обширная хирургическая операция, необходимая для проведения лечения. “Необходимо будет разработать наилучшие способы ускорить проведение этой операции”, — говорит она. “Мы уже работаем над решением этой задачи».
По словам Рубинштейна, сохранение положительных результатов важно не только при болезни Хантингтона. “микроРНК легко доставлять, потому что они маленькие. Таким образом, это открывает множество возможностей” для потенциальных методов лечения других нейродегенеративных заболеваний, включая болезнь Паркинсона. Другие методы лечения с использованием вирусных векторов уже одобрены для лечения редких заболеваний, таких как дефицит декарбоксилазы ароматических L-аминокислот (AADC).
Снелл выразил удовлетворение тем, что компания опубликовала результаты, пусть даже предварительные. “Дело не в нас, фанатах науки”, — говорит Снелл, который прослезился, когда поделился своей реакцией на результаты. “Речь идет о семьях, о смелых людях, которые присоединились к этому испытанию”.