Исследователи из Медицинского центра Джона Хопкинса говорят, что они разработали новый инструмент, основанный на электронных медицинских записях, который должен помочь врачам предсказать, какие пациенты наиболее подвержены риску потери трансплантированной почки.
В исследовании, опубликованном в Клиническом журнале Американского общества нефрологов, представлена динамическая модель прогнозирования риска, которая использует обычные лабораторные результаты — в частности, изменения функции почек с течением времени — для прогнозирования того, откажет ли пересаженная почка (трансплантат) в течение трех лет после операции.
В связи с ростом заболеваемости почек, когда, по оценкам, 15% взрослых в Соединенных Штатах страдают хронической болезнью почек (ХБП), необходимость снижения вероятности прогрессирования у пациентов терминальной стадии почечной недостаточности (ТБПН) становится все более актуальной. Трансплантация почки считается идеальным методом лечения ТБПН, поскольку она обеспечивает более длительную выживаемость и лучшее качество жизни по сравнению с процедурами диализа.
Хотя обычно успешная трансплантация почки длится около 10 лет, четвертая часть трансплантатов может дать сбой в течение первых пяти лет после трансплантации. Это еще раз иллюстрирует важность выявления реципиентов почечного трансплантата, подверженных риску ухудшения состояния трансплантата, для лучшей оптимизации результатов в долгосрочной перспективе для пациентов, перенесших трансплантацию почки.
Исследователи полагают, что скрининг реципиентов почечного трансплантата с высоким риском несостоятельности аллотрансплантата может помочь в консультировании и выборе возможных вариантов лечения для предотвращения прогрессирования. Они надеются, что выявление аллотрансплантатов, подверженных риску отказа, потенциально позволит своевременно принимать меры, такие как более частое наблюдение с тщательным мониторингом повреждения аллотрансплантата и его причин, модифицированная иммуносупрессия и консультирование пациентов о необходимости повторной трансплантации или эмоциональном бремени, связанном с повторным достижением ТБПН.
И наоборот, пациенты с низким риском несостоятельности трансплантата могут быть выписаны из—под наблюдения своего нефролога—трансплантолога и переведены обратно к своему основному нефрологу — часто ближе к дому — для продолжения лечения и предоставления возможностей в центре трансплантации для других пациентов, нуждающихся в трансплантационной помощи.
После пересадки почки врачи внимательно следят за тем, насколько хорошо работает орган, часто используя лабораторный показатель, называемый расчетной скоростью клубочковой фильтрации (REGFR). Новая модель, которую исследователи использовали в исследовании, была направлена на постоянное обновление информации о риске несостоятельности трансплантата у пациента каждый раз, когда измеряется новый результат рСКФ, что позволяет проводить персонализированную оценку риска в режиме реального времени.
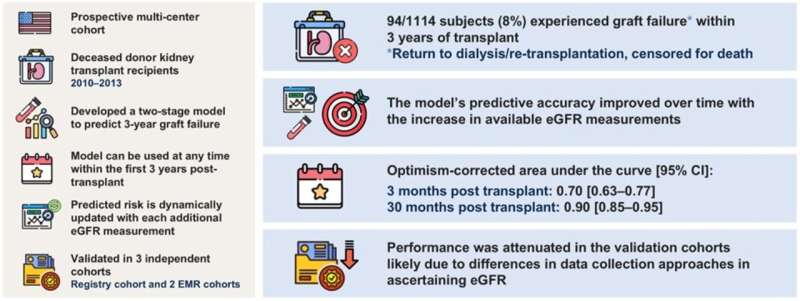
Для разработки нового инструмента исследователи проанализировали данные, зарегистрированные по 1114 умершим реципиентам трансплантата почки от донора из трех регистров — регистра OPTN, когорты EMR Джона Хопкинса и Колумбийской когорты EMR, которые в совокупности насчитывали примерно 80 000 реципиентов трансплантата почки от умершего донора. В частности, они изучили повторные результаты рСКФ — анализа крови, который обычно используется для определения того, насколько хорошо почки отфильтровывают токсины.
«Мы разработали модель прогнозирования в рамках исследования умерших доноров, которое проводилось в режиме наблюдения», — говорит Хизер Тиссен Филбрук, доктор математических наук, помощник директора Центра точной медицины почек при Медицинском университете Джона Хопкинса и основной автор исследования.
Это исследование является богатым источником данных о реципиентах почки, перенесших трансплантацию от умерших доноров, с медианой в 12 последующих измерений рСКФ в течение первых трех лет после трансплантации. Мы проверили модель на широкой выборке, собранной в реестре трансплантологов США, и на двух реальных наборах данных, используя данные, доступные в системах электронных медицинских карт.
В ходе исследования были использованы два этапа моделирования. Одной из моделей была линейная модель смешанных эффектов, которая оценивала динамику рСКФ у каждого пациента с течением времени, чтобы увидеть, как она соотносится с отказом трансплантата. Отказ трансплантата определялся как возвращение к диализу или повторная трансплантация в течение трех лет после первой процедуры. Второй была логистическая модель, предсказывающая несостоятельность трансплантата, в которой использовались траектории рСКФ реципиента, рассчитанные на основе линейной смешанной модели первого этапа.
Во все валидационные группы, использованные в этом исследовании, были включены взрослые реципиенты почек первичного умершего донора, у которых после трансплантации был проведен по крайней мере один анализ сывороточного креатинина — показатель того, насколько хорошо почки выполняют свою работу по фильтрации отходов из крови.
В целом, результаты исследования показали, что двухэтапный подход позволяет эффективно оценивать индивидуальные тенденции рСКФ и гибко моделировать связь между рСКФ и несостоятельностью трансплантата. Через три месяца после трансплантации модель достигла прогностической точности 0,70, а через 30 месяцев после трансплантации модель достигла прогностической точности 0,90, что означает, что она смогла различать пациентов с высоким и низким риском.
«Результаты этого исследования могут быть легко внедрены в трансплантационных центрах для оптимизации ухода за реципиентами трансплантата почки путем предоставления обновленных прогнозов риска по мере поступления новых данных», — говорит Чираг Парих, доктор медицинских наук, директор отделения нефрологии, директор Центра передового опыта в области точной медицины почек в Медицинском институте Джона Хопкинса и старший автор исследования. — В будущем также могут быть разработаны последующие модели для прогнозирования других инфекций и иммунологических осложнений».
Учитывая многообещающие результаты исследования, исследователи планируют протестировать этот инструмент в повседневных клинических условиях и изучить дополнительные данные о состоянии здоровья, такие как клинические события и другие лабораторные измерения, чтобы оптимизировать работу модели при прогнозировании раннего отказа трансплантата.
Дополнительная информация: Heather Thiessen Philbrook и соавт., Динамическое прогнозирование риска несостоятельности трансплантата после трансплантации почки умершему донору, Клинический журнал Американского общества нефрологов (2025). DOI: 10.2215/cjn.0000000883
Информация о журнале: Клинический журнал Американского общества нефрологов.