Небольшое структурное изменение превратило вакцину против рака, вызванного ВПЧ, в гораздо более мощное средство для борьбы с опухолями.
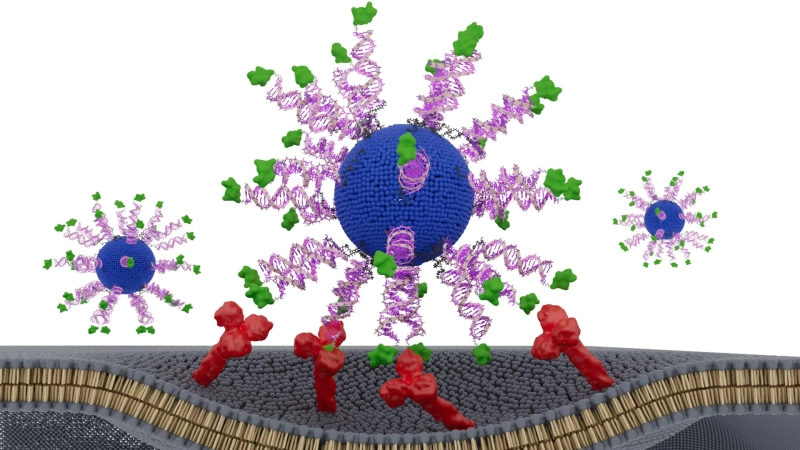
Художественная интерпретация сферической наночастицы нуклеиновой кислоты (SNA), несущей антиген ВПЧ (e7₁₁–₁₉) и ДНК-адъювант CpG, взаимодействующей с рецептором-поглотителем А для облегчения интернализации клеток. Отображение и N-концевая ориентация антигена ВПЧ на N-HSNA усиливают антигенспецифический ответ CD8⁺ Т-клеток и противоопухолевую активность. Автор: Коннор Форсайт и Джейк Коэн из исследовательской группы Миркина/Северо-Западный университет.
За последнее десятилетие ученые из Северо-Западного университета выяснили, как работают вакцины. Ингредиенты имеют значение, но то, как они физически расположены, может существенно повлиять на эффективность.
После подтверждения этой концепции в ходе многочисленных исследований исследователи применили ее к терапевтическим противораковым вакцинам, направленным на борьбу с опухолями, вызываемыми ВПЧ. В своей последней работе они обнаружили, что простое изменение ориентации и положения одного пептида, нацеленного на рак, значительно усиливает способность иммунной системы атаковать опухоли.
Исследование было опубликовано 11 февраля в журнале Science Advances.
Тестирование сферической вакцины на основе нуклеиновых кислот
Чтобы развить эту идею, команда создала вакцину, построенную на основе сферической нуклеиновой кислоты (SNA), глобулярной структуры ДНК, которая естественным образом проникает в иммунные клетки и активирует их. Затем они намеренно реорганизовали компоненты SNA, придав им несколько различных конфигураций. Каждая версия была протестирована на гуманизированных животных моделях ВПЧ-позитивного рака и на образцах опухолей, взятых у пациентов с раком головы и шеи.
Одна из конфигураций, несомненно, дала превосходные результаты. Она уменьшала рост опухоли, увеличивала выживаемость животных и генерировала большее количество высокоактивных противораковых Т-клеток. Полученные результаты показывают, что даже небольшое изменение в компоновке компонентов вакцины может определить, вызывает ли нановакцина ограниченный иммунный ответ или мощный эффект, разрушающий опухоль.
Этот принцип лежит в основе развивающейся области, известной как «структурная наномедицина», термин, введенный пионером северо-западной нанотехнологии Чедом А. Миркином. В центре внимания этой области находятся SNAs, которые изобрел Миркин.
«В больших и сложных лекарственных препаратах есть тысячи переменных, которые определяют эффективность вакцин», — сказал Миркин, возглавлявший исследование. «Потенциал структурной наномедицины заключается в том, чтобы из множества возможных конфигураций определить те, которые обеспечивают наибольшую эффективность и наименьшую токсичность. Другими словами, мы можем создавать более совершенные лекарства «снизу вверх».
Миркин — профессор химии, химической и биологической инженерии, биомедицинской инженерии, материаловедения и инженерной инженерии и медицины в Северо-Западном университете имени Джорджа Б. Ратмана. Он работает в Колледже искусств и наук Вайнберга, инженерной школе Маккормика и медицинской школе Фейнберга Северо-Западного университета. Он также руководит Международным институтом нанотехнологий и является сотрудником Комплексного онкологического центра имени Роберта Х. Лурье при Северо-Западном университете. Он руководил исследованием совместно с доктором Йохеном Лорхом, профессором медицины в Фейнберге и директором медицинской онкологической программы по борьбе с раком головы и шеи в Northwestern Medicine.
Выход за рамки традиционного подхода к смешиванию вакцин
Разработка традиционной вакцины часто предполагает комбинирование ключевых ингредиентов без точного контроля структуры. В иммунотерапии рака молекулы, полученные из опухоли, называемые антигенами, соединяются с иммуностимулирующими соединениями, известными как адъюванты. Они смешиваются вместе и вводятся в виде единого препарата.
Миркин описывает это как «смешанный подход», при котором компоненты не имеют четкой организации.
«Если вы посмотрите, как развивались лекарства за последние несколько десятилетий, то увидите, что мы перешли от четко определенных небольших молекул к более сложным, но менее структурированным лекарствам», — сказал Миркин. «Вакцины против COVID-19 являются прекрасным примером — нет двух одинаковых частиц. Несмотря на то, что они очень впечатляющие и чрезвычайно полезные, мы можем добиться большего, и для создания наиболее эффективных противораковых вакцин нам придется это сделать».
Исследования, проведенные лабораторией Mirkin, показывают, что размещение антигенов и адъювантов в тщательно разработанных наноразмерных структурах может значительно улучшить результаты. При правильной компоновке одни и те же ингредиенты могут оказывать более сильное воздействие при меньшей токсичности по сравнению с неструктурированными смесями.
Команда уже использовала эту стратегию структурной наномедицины для разработки вакцин SNA, нацеленных на меланому, тройной негативный рак молочной железы, рак толстой кишки, рак предстательной железы и рак клеток Меркеля. Эти кандидаты показали обнадеживающие результаты в доклинических исследованиях, и семь препаратов на основе СНС прошли клинические испытания на людях при различных заболеваниях. СНС также включены в более чем 1000 коммерческих продуктов.
Усиление реакции CD8-Т-клеток против рака, вызванного ВПЧ
В новом исследовании ученые сосредоточились на раке, вызванном вирусом папилломы человека, или ВПЧ. ВПЧ является причиной большинства случаев рака шейки матки и увеличения процента случаев рака головы и шеи. Хотя профилактические вакцины против ВПЧ могут остановить инфекцию, они не лечат уже развившийся рак.
Чтобы удовлетворить эту потребность, команда создала терапевтические вакцины, предназначенные для активации «киллерных» Т-клеток CD8, наиболее мощных противораковых клеток иммунной системы. Каждая наночастица включала липидное ядро, иммуноактивирующую ДНК и короткий фрагмент белка ВПЧ, уже присутствующего в опухолевых клетках.
Каждая версия вакцины содержала идентичные ингредиенты. Единственной переменной было положение и ориентация пептида, полученного из ВПЧ, или антигена. Исследователи протестировали три модели. В одной из них пептид был спрятан внутри наночастицы. В двух других он был нанесен на поверхность. В поверхностных версиях пептид был прикреплен либо к N-концу, либо к С-концу, и это небольшое различие может повлиять на то, как иммунные клетки распознают и обрабатывают его.
Версия, в которой антиген был представлен на поверхности, прикрепленный через N-конец, вызывал наиболее сильную иммунную реакцию. Это активировало в восемь раз больше гамма-интерферона, важного противоопухолевого сигнала, вырабатываемого Т-клетками-киллерами. Эти Т-клетки оказались значительно более эффективными в уничтожении ВПЧ-позитивных раковых клеток. В экспериментах на гуманизированных мышах рост опухоли заметно замедлился. В образцах опухолей, взятых у пациентов с ВПЧ-положительным раком, количество раковых клеток увеличилось в два-три раза.
«Этот эффект был достигнут не за счет добавления новых ингредиентов или увеличения дозы», — сказал Лорх. «Это произошло благодаря более рациональному использованию тех же компонентов. Иммунная система чувствительна к геометрии молекул. Оптимизируя способ присоединения антигена к СНС, иммунные клетки обрабатывают его более эффективно».
Усовершенствованная разработка противораковых вакцин с использованием точности и искусственного интеллекта.
В настоящее время Mirkin планирует пересмотреть предыдущие вакцины-кандидаты, которые продемонстрировали потенциал, но не смогли вызвать достаточно сильных иммунных реакций у пациентов. Демонстрируя, что наноразмерная структура напрямую влияет на иммунную активность, это исследование предлагает основу для совершенствования терапевтических противораковых вакцин с использованием существующих компонентов. Такая стратегия может ускорить разработку и снизить затраты.
Он также ожидает, что искусственный интеллект станет важным инструментом в разработке вакцин. Системы машинного обучения смогут быстро анализировать огромное количество структурных комбинаций для определения наиболее эффективных механизмов.
«Этот подход может изменить способ разработки вакцин», — сказал Миркин. «Возможно, мы отказались от вполне приемлемых компонентов вакцины просто потому, что они имели неправильную конфигурацию. Мы можем вернуться к ним, перестроить и превратить их в сильнодействующие лекарства. Вся концепция структурной наномедицины — это большой поезд, мчащийся по рельсам. Мы доказали, что структура имеет значение — последовательно и без исключений».
Исследование «Расположение и ориентация E711-19 определяют реакцию CD8+ Т-клеток в структурно определенных сферических вакцинах на основе нуклеиновых кислот» было поддержано Национальным институтом рака (номера наград R01CA257926 и R01CA275430), Семейным фондом Лефкофски и Комплексным онкологическим центром Роберта Х. Лурье при Северо-Западном университете.